▲第一作者:Hyunchul Oh
通讯作者:Michael Hirscher, Torben R. Jensen, Yaroslav Filinchuk
通讯单位:日本东北大学,丹麦奥胡斯大学,比利时天主教鲁汶大学
DOI:10.1038/s41557-024-01443-x
氢作为个人和公共交通工具的燃料的广泛使用受到氢存储的巨大挑战的限制。当前技术主要集中在分子氢在气态或液态时的储存。不幸的是,当前技术能提供的容积和重量密度有限。作为分子,氢可以通过弱范德华相互作用在多孔材料中物理吸附。多孔材料提供高重量比的氢吸附,但容积储存能力仍需要改进。纳米多孔材料因其气体存储性能而受到广泛关注,但实现高容积储氢仍然是一个挑战。通过使用中子粉末衍射、容积式气体吸附、非弹性中子散射和第一性原理计算,本研究分析了一种具有小孔和部分带负电非平坦内部的镁硼氢框架,用于氢和氮的吸收。氢和氮分别占据孔中不同的吸附位点,其极限容量相差很大,分别为每个Mg(BH4)2分子容纳2.33个H2和0.66个N2。分子氢被极其密集地填充,其密度约为液态氢的两倍(每升孔容积144克H2)。本研究还发现了一种五氢二聚体,它的其中一个位置的H2分子具有旋转自由度,而另一种位置的H2分子具有明确定向,并与框架具有定向相互作用。这项研究揭示了在常压下,密集填充的氢可以在小孔材料中稳定储存。
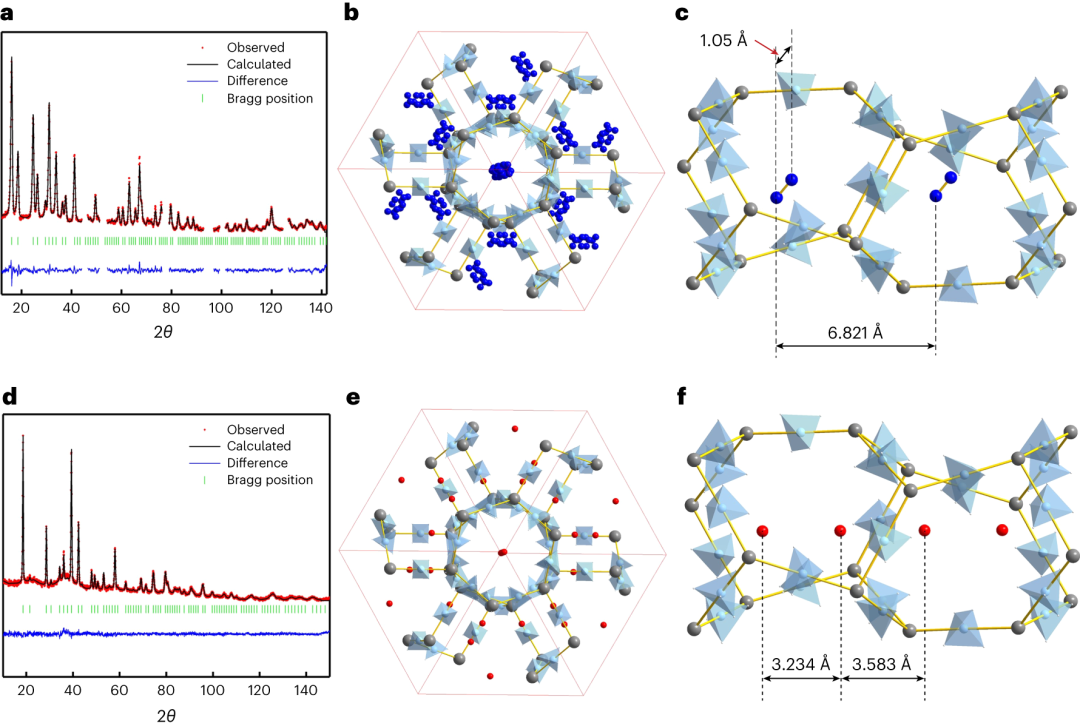
图1|氮和氘负载γ-Mg(11BD4)2的NPD剖面,以及晶体结构的投影。
1.本研究发现,D2并不像N2那样位于孔的中心位置(图1b,c)。相反,D2分子位于孔的出口附近,孔中的两个D2分子是对称等价的,并用一个晶体学位点D11来描述(图1e,f)。2.这种结构的组成对应于每个Mg(BD4)2的4/3 D2,即Mg(BD4)2·1.33D2,并且这在P=27 mbar和T=25 K下很容易饱和。在结构模型中,氘被一个量子转子表示,通常被称为“超原子”,它的质心是围绕D2分子质心的核密度球;也就是说,分子在质心周围具有完全自由的旋转。它用一个位置参数、一个占位因子(表示分子中的两个原子,即占位数为2表示一个分子)和一个原子位移参数来描述。D11位点位于三倍轴上,沿立方晶胞的[111]方向形成1D链(图1e)。在同一个孔内和不同孔之间,氘分子之间的客体-客体接触分别为3.234(5)Å和3.583(5)Å(图1f)。
图2|在25K和203 mbar下负载氘的γ-Mg(11BD4)2。
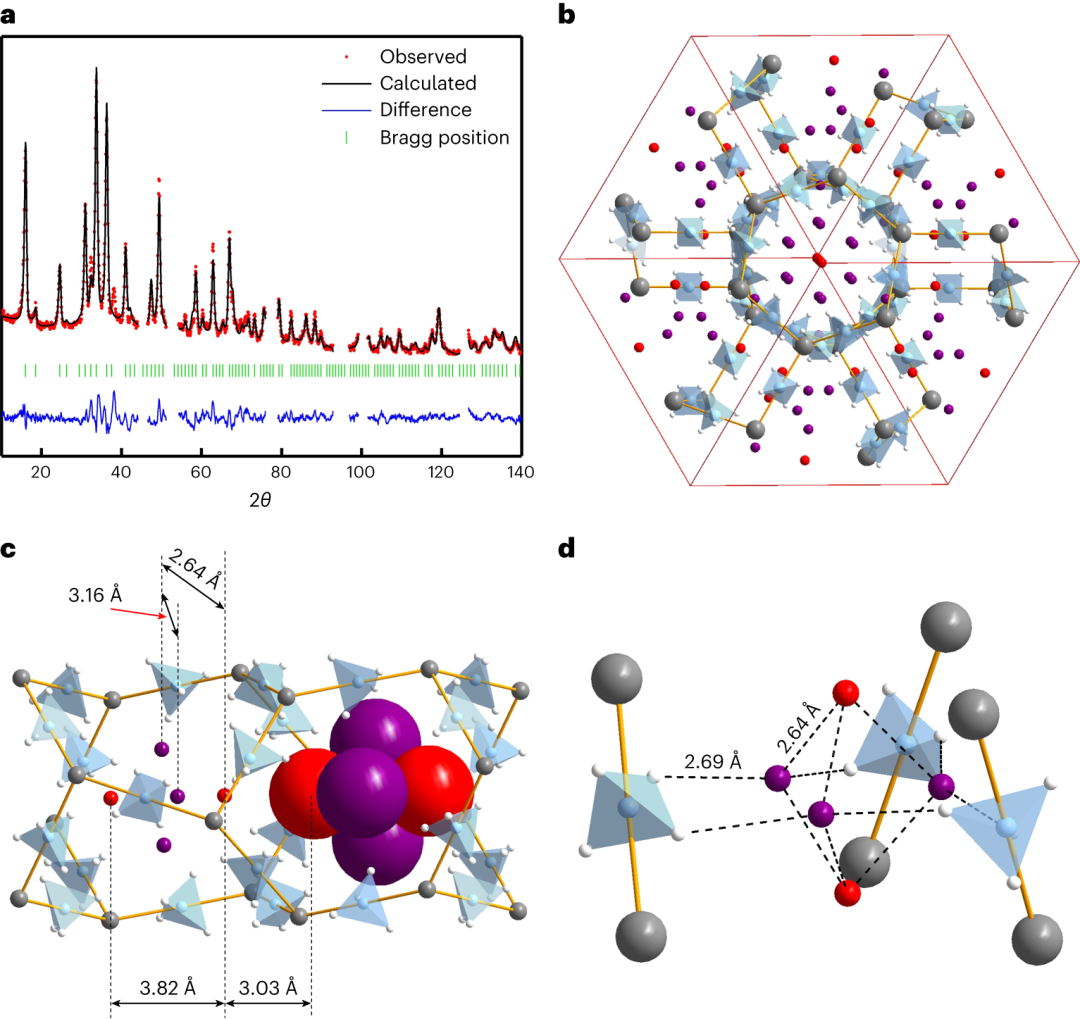
1.在较高的氘压力下,在25 K下,本研究观察到了第二阶段的气体吸收。NPD数据的分析表明,第二个D2位点,标记为D22,开始被占据(图2b),在pD2= 205 mbar和T=25K下达到饱和。D22位点并不位于三倍轴上,而是通过通道中心,从而在两个旁路通道之间形成一个短的D22...D22距离(1.94Å)。因此,D22位点的极限占用率为50%。仔细重新分析在pD2 = 27 mbar和T=25K下测得的衍射数据表明,在这一压力下D22位点填充了14%,而在203 mbar下它变成了完全占据(50%),达到γ−Mg(BD4)2·2.33D2的极限组成,即同时占据D11和D22位置。Rietveld精修谱如图2a所示。额外的弱衍射峰出现在γ-Mg(BD4)2·2.33D2的NPD图案中,表明这个体心结构变成变成原始结构,很可能是由于D22位点在一个更低对称性的空间群(可能是Pa−3)中的顺序。
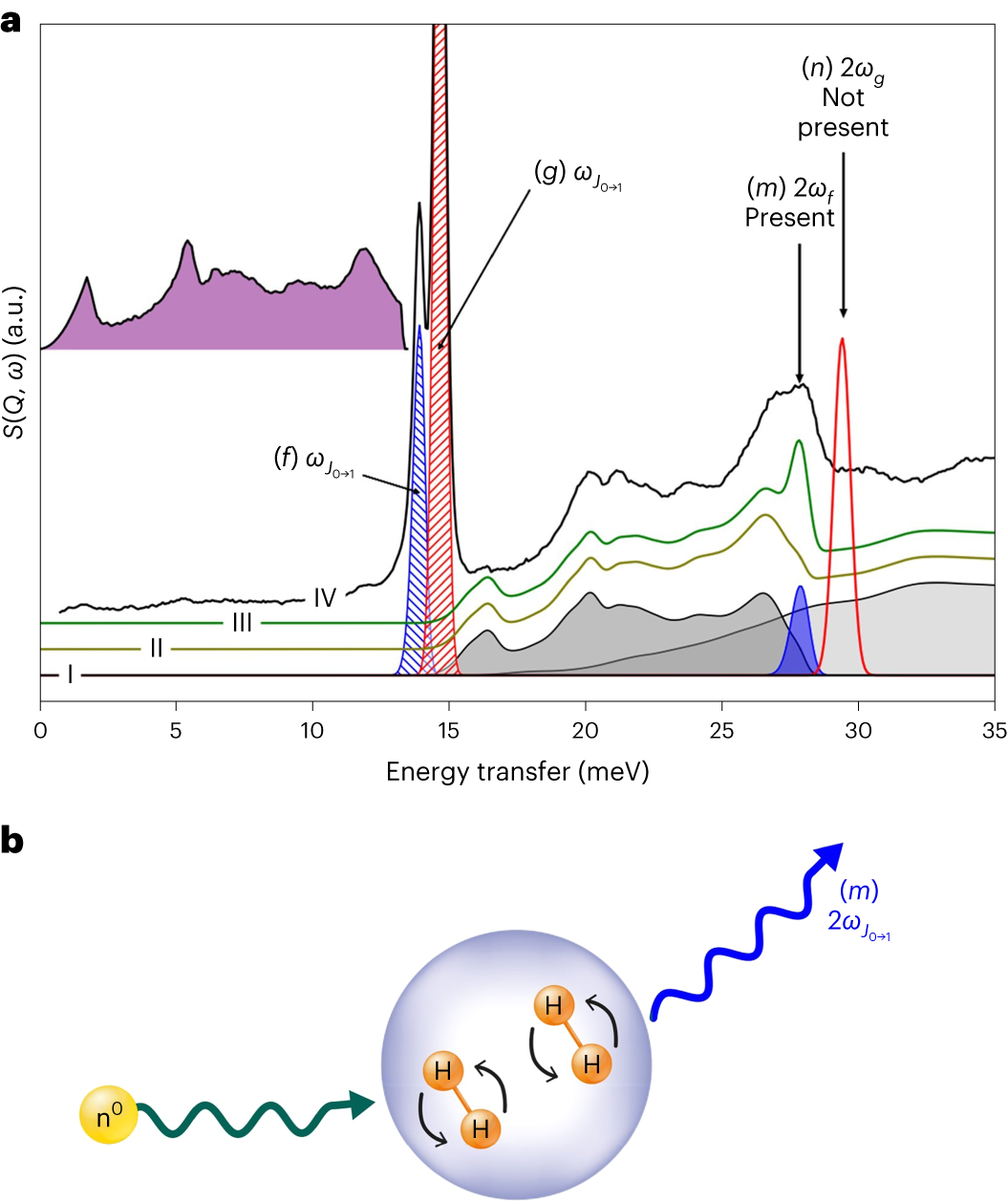
图3|负载氘的γ-Mg(BD4)2的非弹性中子散射光谱
1.图3a展示了γ-Mg(BD4)2上吸附的氢(p-H2)的INS谱,对应于Mg(BD4)2·1.46H2。通过对约30%无定形非多孔硼氢化镁进行修正,晶体多孔部分的有效负载为每个Mg原子2.06个H2,表明D11位点完全负载,D22位点负载很大。谱图包含两个旋转峰,分别为13.9 meV和14.6 meV。较高能量的跃迁与自由氢转子一致(图3a,红色虚线区域),类似于固态氢和受限氢。因此,它可以归属于D11位点。第二个旋转峰的强度较低,能量较低,与受干扰的转子一致(蓝色虚线区域),并可以归因于D22位点。
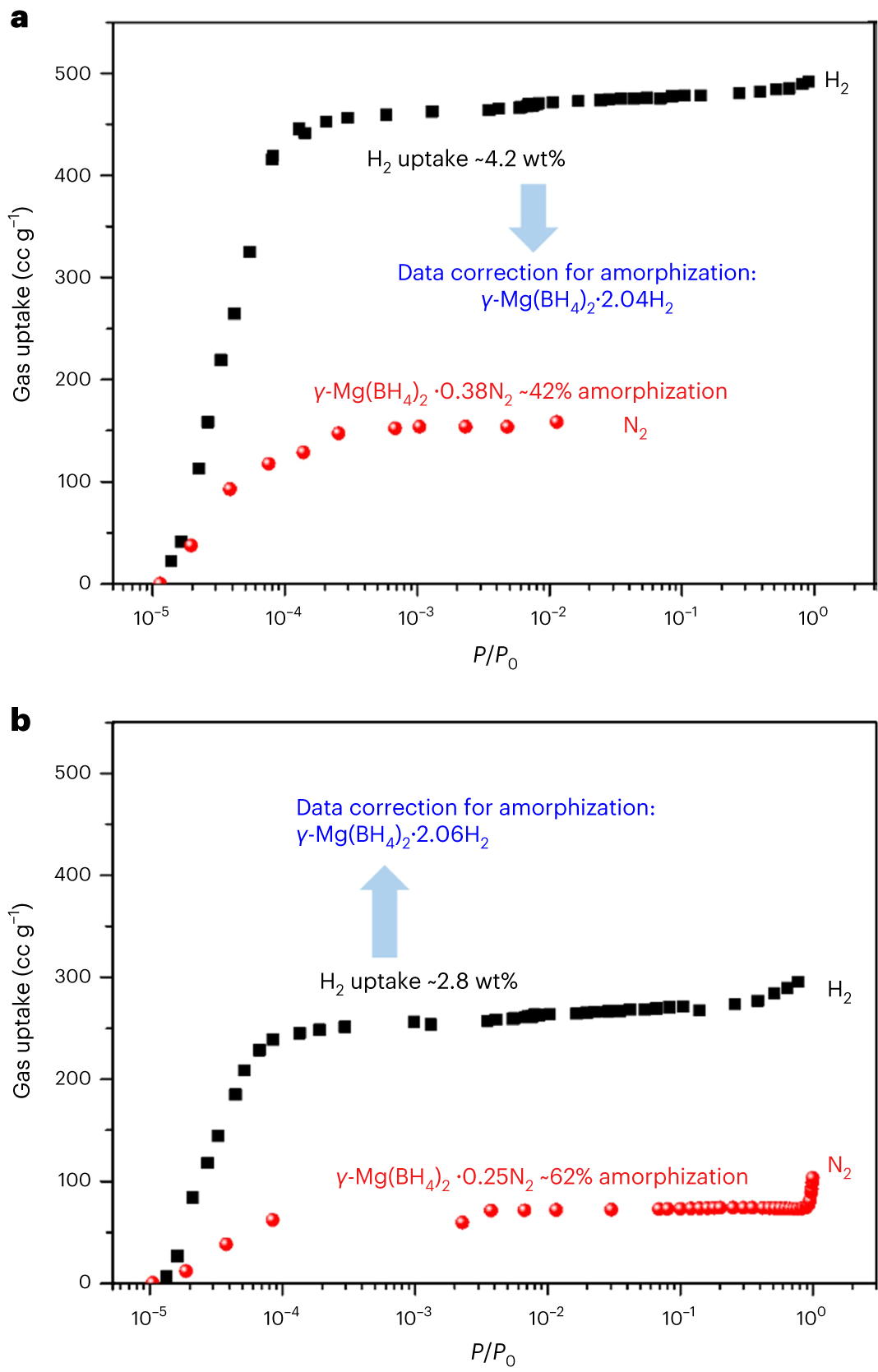
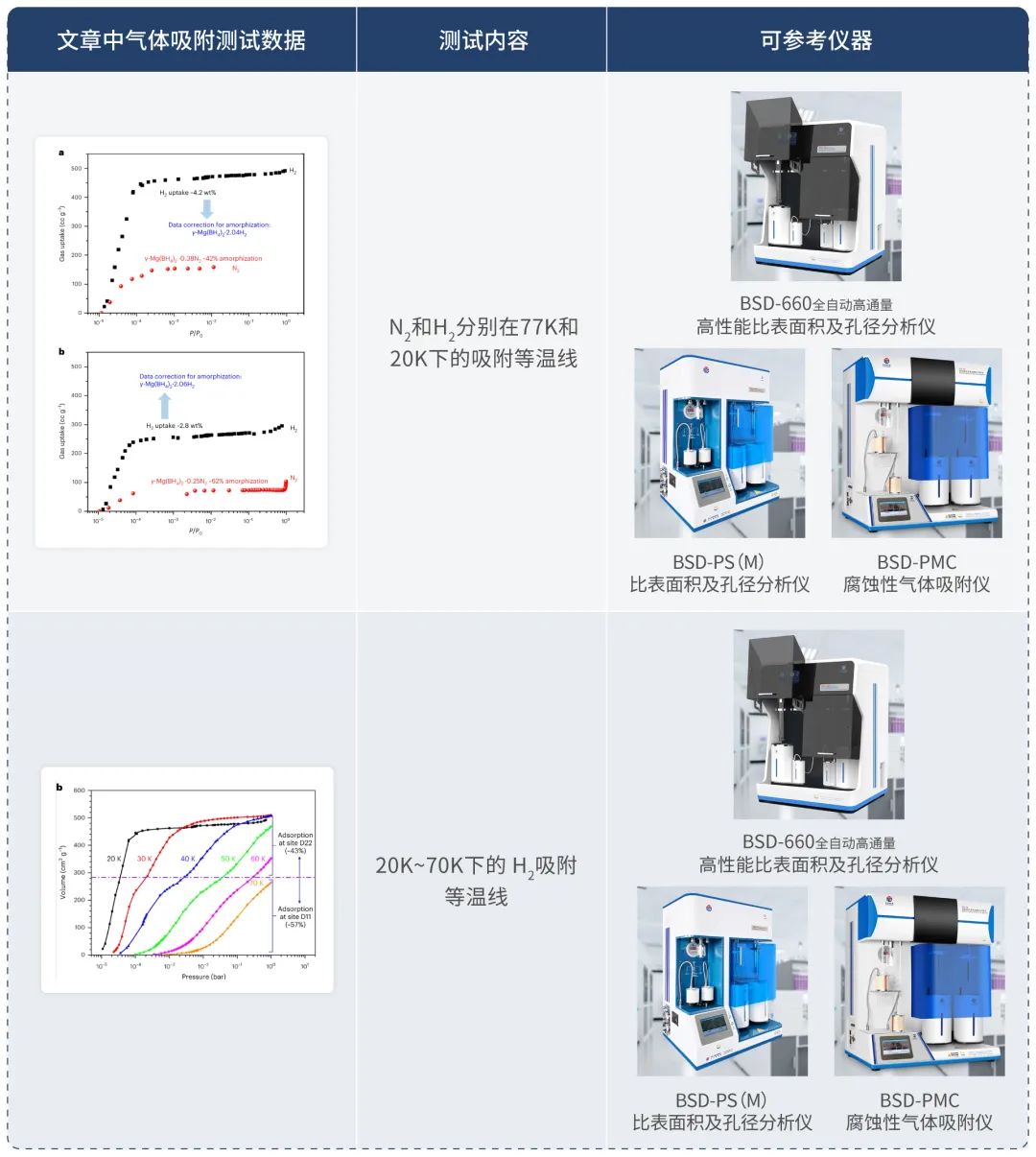
图4| N2和H2分别在77K和20K下的吸附等温线
1.本研究发现,相比于每个样品中N2的吸附,H2的吸附大约多出三倍。这可能是两种相似的探针分子,H2和N2,具有非常不同的与表面拓扑相互作用。与图4中的气体吸收类似,从77 K的N2等温线确定的γ-Mg(BH4)2的Brunauer–Emmett–Teller(BET)比表面积仅为SBET(N2)= 610 m2 g−1,而从20 K的H2等温线计算的SBET(H2)= 1,787 m2 g−1或1,577 m2 g−1,分别基于液态或固态密度下的氢分子的横截面积(图4a)。此外,从77K的N2等温线确定的γ-Mg(BH4)2的总比孔体积(SPV,最大吸收量/样品质量/液体气体密度)仅为0.12 ml g−1,而从20K的H2等温线计算的SPV为0.51 ml g−1。2.晶体学研究揭示,γ-Mg(BH4)2中的孔径和孔口允许H2和N2进入并达到饱和。因此,本研究提供了明确的证据,表明由于与非平面表面拓扑的不同相互作用,测量的比表面积与探针分子之间存在强烈的相关性,而不是由孔径大小调节对结构多孔区域的限制性进入。请注意,即使由于样品非晶化而导致总吸收量减少(图4b),探针分子效应仍然表现出相似的趋势(对于第二批样品,SBET(N2)= 310 m2 g−1和SBET(H2)= 1,110 m2 g−1,基于液态或固态H2的横截面积,SPV(N2)= 0.08 ml g−1和SPV(H2)= 0.41 ml g−1; 图4b)。
图5|通过容积法表征γ-Mg(BH4)2中氢的吸附
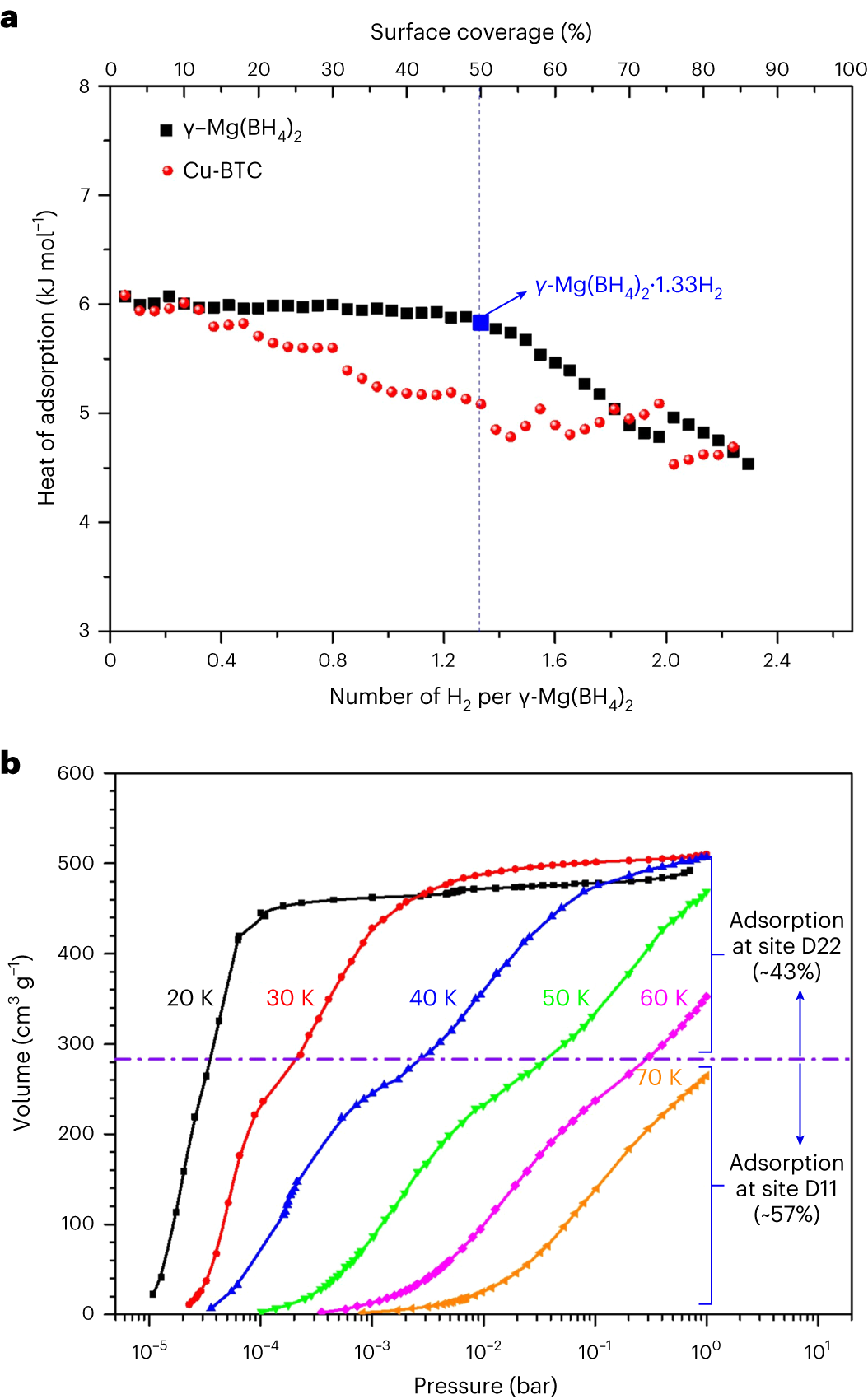
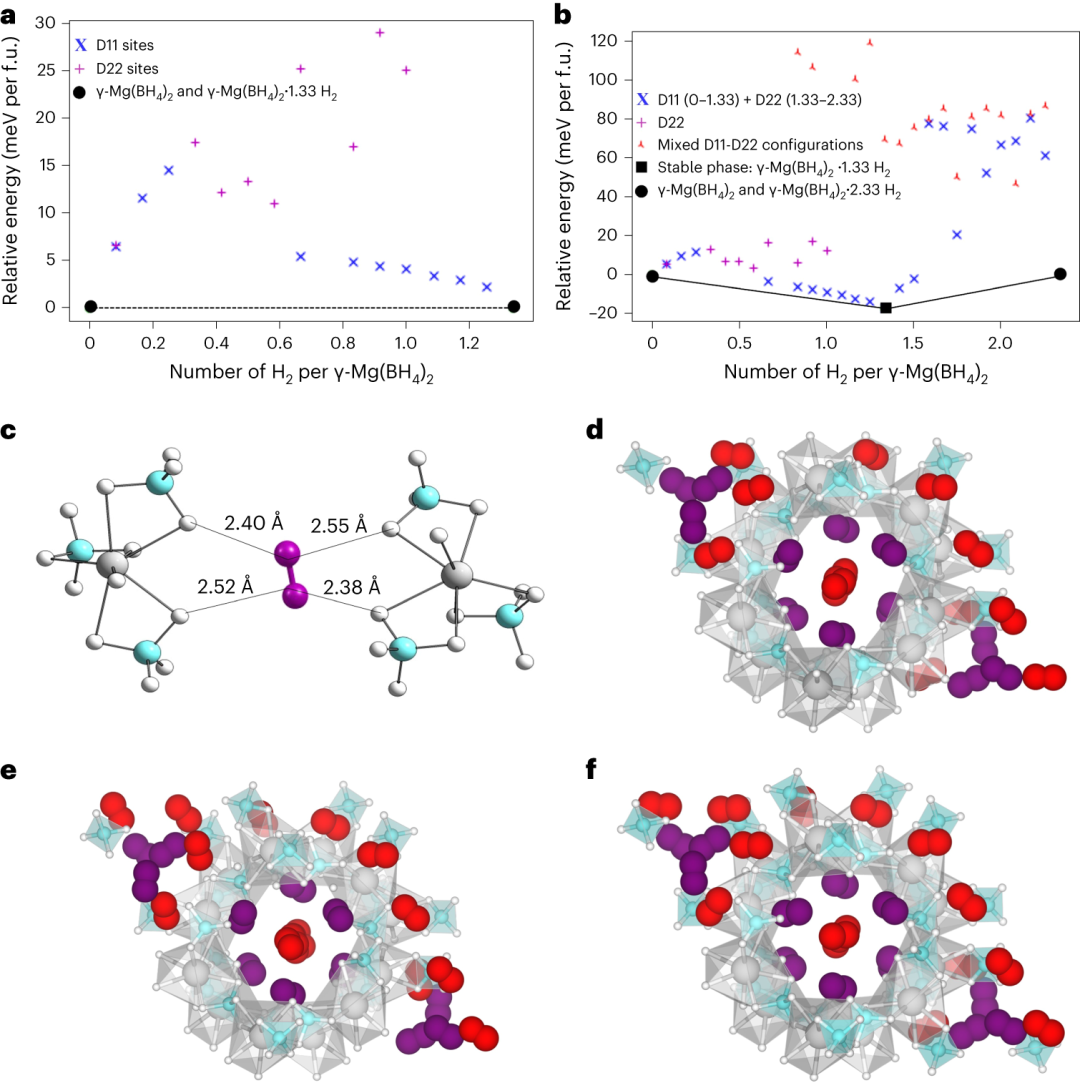
1.温度依赖的气体吸附实验还提供了对吸附等温线热等温吸附热的了解,这些热量表征了宿主-客体和客体-客体相互作用的强度。图5a显示了γ-Mg(BH4)2和具有类似孔径和H2吸收的铜苯-1,3,5-三羧酸(Cu-BTC)MOF的等温线覆盖率函数的氢吸附等温线热。氢吸附焓在覆盖率约为50%以下时几乎保持不变,为6.1 kJ mol-1,然后下降到4.5 kJ mol-1,而类似的MOF,如Cu-BTC,通常随覆盖率而下降。随着负载量超过1.33 H2per Mg,等温线吸附热的下降可以通过涉及D22位点中的原子的宿主-客体和客体-客体排斥来解释,这也与晶胞体积的0.67%扩张相吻合(而在填充D11位点时未观察到扩张)。2.进一步的证据也观察到高分辨率低压H2吸附等温线,如图5b所示。在对数压力标度中,等温线呈现出两步行为,表明在具有不同保留能量的两个主要位点上顺序吸附。假设这些位点中的单层吸附,第一吸附位点(D11)中预期的最大氢含量为总吸收量的约57%。因此,剩余的约43%被指定为第二个位点(D22),这也与NPD结果非常吻合。图6|γ-Mg(BH4)2上的H2吸附的热力学凸包分析,以及γ-Mg(BH4)2上(B−Hδ−)2···H−H···(Hδ−−B)2连接性的示意图和H2分布。
纳米多孔γ-Mg(BH4)2是一个具有部分带负电氢原子的杂化框架,从而形成了孔的内表面。N2和H2分子都可以进入小孔,但是H2的气体吸收量是N2的三倍。N2位于孔的中心,而H2分子则位于BH4基团的部分带负电氢原子附近的自己的位点。本研究强调了开发具有高密度氢储存能力的杂化多孔框架的机会,或作为未来可能具有高温超导性和接近常压稳定性的材料。孔中的高H2密度是由于H2分子的异性形状,通常在接近常压下看到的是密集堆积的椭球体。此外,在非常高的压力下,氢分子可能会显示出更复杂的有序模式。虽然前人已经报道了H2分子形成所谓的氢聚集体,其中H2的分子间距实际上被拉长。然而,本研究通过实验和理论计算观察到,整个过程只形成了一个五氢分子簇,其中两个分子围绕它们的质心自由旋转,其中仅通过范德华相互作用结合。这与另外三个形成六氢键的分子形成对比,(B−Hδ−)2···H−H···(Hδ−−B)2。此外,理论计算显示,形成五氢二聚体的方式比氢在两个位置上的统计分布更有利。这些类型的氢相互作用与之前理论上定义的涉及杂化氢或电荷反转氢键的三氢键不同。
贝士德 吸附表征 全系列测试方案

1、填写《在线送样单》
2、测样、送检咨询:杨老师13810512843(同微信)